ECLS et ECMO : révolution ou risque ?
Matthias Hänggi
Prof. Dr méd., Institut für Intensivmedizin, Universitätsspital Zürich
David Berger
Prof. Dr méd., Intensivstation, Departement Akutmedizin, Universitätsspital Basel, Department of Biomedical Engineering, University of Basel, Basel
Roger Ludwig
Dr méd., Universitätsklinik für Intensivmedizin, Universitätsspital Bern –Inselspital
Nadja Schai
Dre méd., Universitätsklinik für Intensivmedizin, Universitätsspital Bern –Inselspital
Raphaël Giraud
PD Dr méd., Service des soins intensifs, Département de médecine aiguë, Hôpitaux Universitaires de Genève
Gian-Reto Kleger
Dr méd., Klinik für Intensivmedizin, Kantonsspital St.Gallen
Patricia Fodor
KD Dr méd., Institut für Intensivmedizin, Stadtspital Zürich
Luca Cioccari
PD Dr méd., Klinik für Intensivmedizin, Kantonsspital Aarau
Andreas Bloch
PD Dr méd., Zentrum für Intensivmedizin, Luzerner Kantonsspital
Tiziano Cassina
Prof. Dr méd., Servizio di Cardioanestesia e Medicina intensiva, Istituto Cardiocentro Ticino, Lugano
Lise Piquilloud
MER et PD, Service de médecine intensive adulte, Centre hospitalier universitaire vaudois, Lausanne
« Airway, Breathing, Circulation » : soit les bases de la vie. Les troubles graves de cette triade ABC sont incompatibles avec la survie. La machine cœur-poumon (MCP) a été développée dans les années 1950 pour la chirurgie cardiaque. L’utilisation de la MCP sous forme d’ECLS (extracorporeal life support) en dehors du contexte chirurgical fut initialement un échec. Ce n’est qu’en 1971 que le premier patient a survécu 75 heures sous ECMO (extracorporeal membrane oxygenation), après l’échec du traitement conventionnel du syndrome de détresse respiratoire aiguë (SDRA) [1]. Toutefois, les premières études sont restées négatives, avec des taux de mortalité > 90 % [2]. Les développements dans le domaine de la biocompatibilité des membranes, des pompes centrifuges et de la miniaturisation ont abouti au début du siècle à des appareils techniquement matures et relativement maniables. Cependant, l’expérience faisait toujours défaut, les indications n’étaient pas claires et il n’existait aucune étude sur les appareils modernes d’ECMO. Par conséquent, le traitement par ECMO était rarement utilisé. La pandémie de grippe H1N1 de 2009, avec ses nombreux patients atteints de SDRA, a marqué le tournant dans l’histoire de l’ECMO. Le nombre de traitements, d’appareils et de centres proposant ces thérapies a connu une croissance exponentielle. Au plus tard avec la pandémie de COVID-19 au cours de laquelle plus de 20 000 traitements de ce type ont été effectués, l’ECMO s’est établie et est devenue connue du grand public [3].
Possibilités de l’ECMO et preuves
Un appareil d’ECLS / ECMO moderne est maniable, transportable et intègre tous les composants essentiels : la pompe qui transporte activement le sang, l’oxygénateur qui permet l’échange gazeux et l’unité de contrôle et de commande. Le sang est drainé par de grandes canules (jusqu’à 32 French = 11 mm de diamètre interne), acheminé vers la pompe, dirigé vers l’oxygénateur et restitué au patient par une canule légèrement plus petite. Les vaisseaux sanguins dans lesquels les canules sont insérées dépendent de l’indication de l’ECMO et varient également d’un centre à l’autre.
En cas de troubles exclusifs de la fonction pulmonaire, le sang est généralement aspiré au niveau de la veine cave inférieure, passé dans l’oxygénateur et renvoyé par la veine jugulaire en amont de l’oreillette droite (ECMO veino-veineuse, ECMO-VV).
En cas de défaillance cardiaque droite et / ou gauche (avec ou sans troubles pulmonaires associés), le sang est drainé dans la veine cave ou dans l’oreillette droite, de manière analogue à l’ECMO-VV, mais il est ensuite restitué par voie artérielle, le plus souvent dans l’artère fémorale, parfois dans l’aorte ascendante dans le cadre périopératoire (ECLS ou ECMO veino-artérielle, ECMO-VA). L’ECPR (= réanimation cardiopulmonaire extracorporelle) est la forme extrême de l’ECMO-VA : la pose de l’ECLS / ECMO se fait chez des patients en cours de réanimation.
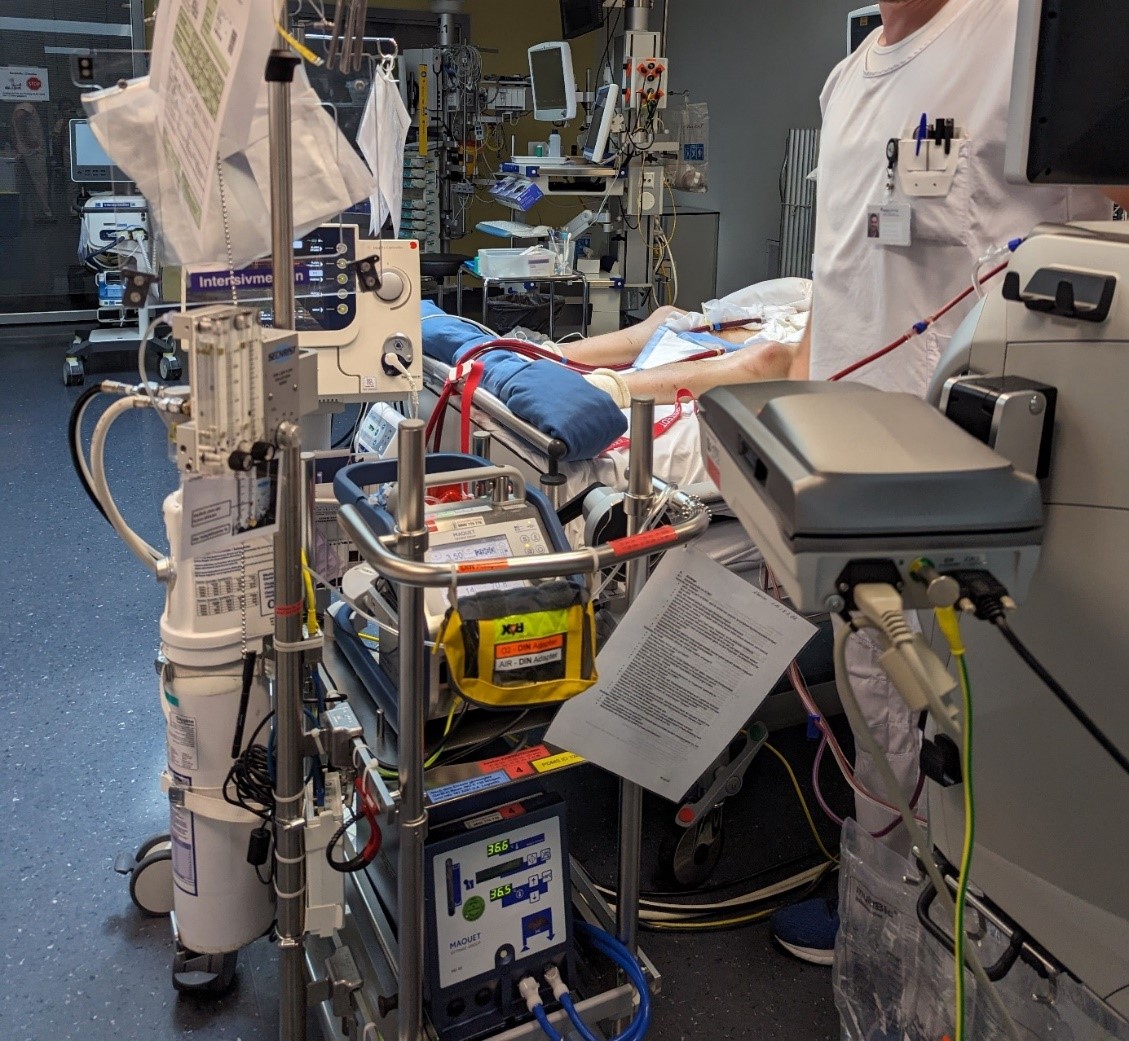
L’appareil bleu au centre de l’image (haut du chariot) est l’ECMO. Les deux tuyaux qui mènent au patient transportent le sang désoxygéné du patient et le sang oxygéné vers le patient. Le chauffage de l’ECMO (bas du chariot) évite que le patient ne se refroidisse sur la durée grâce à la circulation extracorporelle. (© Matthias Exl, Inselspital Bern)
Ce que nous décrivons brièvement ici est, dans la pratique, compliqué, coûteux et risqué et nécessite beaucoup de ressources. Compte tenu de la gravité de la maladie des patients, des évènements soudains peuvent directement entraîner le décès. La liste des complications est longue et peut être sommairement divisée en problèmes techniques (y compris les problèmes de mise en place des canules), complications hémorragiques, circulatoires et vasculaires, ainsi que complications neurologiques et infectieuses.
Au vu du caractère invasif de la procédure et des défis mentionnés, les indications pour l’utilisation de l’ECMO doivent être clairement formulées. Toutes les formes d’ECMO ont en commun le fait qu’elles ne font que gagner du temps pour traiter la maladie sous-jacente.
Dans le domaine de l’ECMO-VV – l’application la plus courante –, l’indication est assez bien circonscrite. Les études CESAR [4] et EOLIA [5] n’ont pas montré d’avantage clair du traitement par EMCO-VV en cas de SDRA sévère, mais leur méthodologie a donné lieu à des discussions. L’étude CESAR a tout de même pu montrer que les patients transférés vers un centre disposant d’une capacité d’ECMO avaient un meilleur devenir, indépendamment du fait qu’ils aient reçu ou non une ECMO dans le centre d’ECMO [4]. L’aspect problématique dans l’évaluation de l’étude « EOLIA » est que 28 % des patients du groupe conventionnel ont reçu une ECMO (« crossover ») parce qu’ils étaient en danger de mort imminente ou qu’ils avaient déjà été victimes d’un arrêt cardiaque [5]. L’analyse des données individuelles des patients des études CESAR et EOLIA a montré un avantage de survie pour les patients souffrant d’une insuffisance pulmonaire sévère [6]. La plupart des experts estiment aujourd’hui que les patients atteints de SDRA qui répondent aux « critères EOLIA » peuvent bénéficier d’un traitement par ECMO-VV.
En ce qui concerne l’ECMO-VA, les données sont moins bonnes. De plus, avec la nouvelle génération de pompes axiales percutanées (par ex. « Impella »), de nouveaux systèmes de soutien mécanique sans oxygénateur sont disponibles. Une méta-analyse des études portant sur toutes les formes de MCS (mechanical circulatory support) n’a montré qu’une amélioration limitée du devenir des patients [7]. Il n’existe donc toujours pas de consensus concernant l’indication et la sélection des patients pour le MCS. Il convient de limiter le MCS aux patients dont la cause de l’insuffisance cardiaque est traitable et de l’utiliser rapidement, avant que le choc n’ait provoqué des dommages secondaires manifestes [8].
Les données concernant les patients victimes d’un arrêt cardiocirculatoire sont également rares. Une étude randomisée réalisée aux États-Unis sur 30 patients a montré que les patients ayant fait l’objet d’un ECLS avaient un devenir significativement meilleur [9]. Deux études plus grandes menées à Prague avec 256 patients [10] et aux Pays-Bas avec 160 patients [11] n’ont formellement pas montré d’amélioration du devenir. Cela illustre les difficultés inhérentes aux études dans ce contexte : il y a un grand nombre de « crossover », et dans l’étude multicentrique hollandaise, de petits centres avec peu d’expérience ont été inclus.
Évaluation et discussion
L’ECMO a élargi et révolutionné les possibilités thérapeutiques en cas de défaillance des fonctions vitales. Certains patients bénéficient de l’ECMO, mais le traitement par ECMO comporte des risques considérables : dans l’étude pragoise mentionnée, 11 % des patients sous ECMO ont été victimes de complications hémorragiques fatales et 22 % ont présenté une hémorragie cérébrale, sans compter les amputations consécutives à des ischémies des jambes et les autres complications graves. Outre les risques pour les patients individuels, il faut également tenir compte de l’investissement considérable et de la mobilisation des ressources qu’elle implique pour les différentes cliniques : pour les patients ECMO instables, un ratio infirmier / patient de 2:1 peut être nécessaire pour la prise en charge. Il en résulte des goulots d’étranglement dans la prise en charge des patients, des reports d’opérations et des transferts d’autres patients dans des hôpitaux plus éloignés. L’étude britannique CESAR a montré que le transfert dans un « acute respiratory failure centre » avec possibilité d’ECMO apporte un avantage en termes de survie, ce qui n’est pas le cas de la machine ECMO elle-même [4]. Les centres d’ECMO avec un grand nombre de cas obtiennent de meilleurs résultats que les centres plus petits [12, 13]. Compte tenu de la complexité du traitement, cela est aisément compréhensible, mais il est impossible de répondre clairement à la question de savoir quel est le « volume critique ». Les lignes directrices internationales recommandent un nombre minimum de cas de 20 patients par an pour l’ECMO-VA et pour l’ECMO-VV [14, 15]. En Suisse, l’utilisation de l’ECMO n’est pas régulée. En 2022, 434 traitements d’ECLS / ECMO (VA, VV et ECPR) ont été effectués dans les unités de soins intensifs suisses. Au vu de ce faible nombre de traitements par ECMO, la question se pose de savoir comment maintenir la qualité du traitement. En outre, il manque des données sur les « patient-related outcome measures » (PROMS). On ignore donc si, en Suisse, tous les patients bénéficient de la révolution ECLS / ECMO ou si certains patients sont exposés à un risque supplémentaire.
Références
- Hill JD, O’Brien TG, Murray JJ, et al. Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung. N Engl J Med 1972;286(12):629-34. DOI: 10.1056/NEJM197203232861204.
- Zapol WM, Snider MT, Hill JD, et al. Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. JAMA 1979;242(20):2193-6. DOI: 10.1001/jama.242.20.2193.
- Report ER. ECLS Registry Report: International Summary, Ann Arbor, Extracorporeal Life Support Organization, 2023. (https://www.elso.org/registry/internationalsummaryandreports/internationalsummary.aspx).
- Peek GJ, Clemens F, Elbourne D, et al. CESAR: conventional ventilatory support vs extracorporeal membrane oxygenation for severe adult respiratory failure. BMC Health Serv Res 2006;6:163. DOI: 10.1186/1472-6963-6-163.
- Combes A, Hajage D, Capellier G, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med 2018;378(21):1965-1975. DOI: 10.1056/NEJMoa1800385.
- Combes A, Peek GJ, Hajage D, et al. ECMO for severe ARDS: systematic review and individual patient data meta-analysis. Intensive Care Medicine 2020;46(11):2048-2057. DOI: 10.1007/s00134-020-06248-3.
- Low CJW, Ling RR, Lau MPXL, et al. Mechanical circulatory support for cardiogenic shock: a network meta-analysis of randomized controlled trials and propensity score-matched studies. Intensive Care Medicine 2024;50(2):209-221. DOI: 10.1007/s00134-023-07278-3.
- Buda KG, Hryniewicz K, Eckman PM, et al. Early vs. Delayed Mechanical Circulatory Support in Patients with Acute Myocardial Infarction and Cardiogenic Shock. European Heart Journal Acute Cardiovascular Care 2024. DOI: 10.1093/ehjacc/zuae034.
- Yannopoulos D, Bartos J, Raveendran G, et al. Advanced reperfusion strategies for patients with out-of-hospital cardiac arrest and refractory ventricular fibrillation (ARREST): a phase 2, single centre, open-label, randomised controlled trial. Lancet 2020;396(10265):1807-1816. DOI: 10.1016/S0140-6736(20)32338-2.
- Belohlavek J, Smalcova J, Rob D, et al. Effect of Intra-arrest Transport, Extracorporeal Cardiopulmonary Resuscitation, and Immediate Invasive Assessment and Treatment on Functional Neurologic Outcome in Refractory Out-of-Hospital Cardiac Arrest: A Randomized Clinical Trial. JAMA 2022;327(8):737-747. DOI: 10.1001/jama.2022.1025.
- Suverein MM, Delnoij TSR, Lorusso R, et al. Early Extracorporeal CPR for Refractory Out-of-Hospital Cardiac Arrest. N Engl J Med 2023;388(4):299-309. DOI: 10.1056/NEJMoa2204511.
- Barbaro RP, Odetola FO, Kidwell KM, et al. Association of hospital-level volume of extracorporeal membrane oxygenation cases and mortality. Analysis of the extracorporeal life support organization registry. Am J Respir Crit Care Med 2015;191(8):894-901. DOI: 10.1164/rccm.201409-1634OC.
- Lebreton G, Schmidt M, Ponnaiah M, et al. Extracorporeal membrane oxygenation network organisation and clinical outcomes during the COVID-19 pandemic in Greater Paris, France: a multicentre cohort study. Lancet Respir Med 2021;9(8):851-862. DOI: 10.1016/S2213-2600(21)00096-5.
- Fischer S, Assmann A, Beckmann A, et al. Empfehlungen der S3-Leitlinie (AWMF) « Einsatz der extrakorporalen Zirkulation (ECLS/ECMO) bei Herz- und Kreislaufversagen ». Zentralbl Chir 2022;148(03):284-292. (In De). DOI: 10.1055/a-1918-1999.
- [Clinical Guideline for Treating Acute Respiratory Insufficiency with Invasive Ventilation and Extracorporeal Membrane Oxygenation]. Chirurg 2021;92(9):851-852. (In ger). DOI: 10.1007/s00104-021-01458-x.
