KI in der pädiatrischen Frakturdiagnostik
Irmhild Altmann-Schneider
Dr. med., PhD, Abteilung für Bilddiagnostik, Universitäts-Kinderspital Zürich
Christian J. Kellenberger
Prof. Dr. med., Abteilung für Bilddiagnostik, Universitäts-Kinderspital Zürich
Michelle Seiler
PD Dr. med., Interdisziplinäre Notfallstation, Universitäts-Kinderspital Zürich
Künstliche Intelligenz (KI) ist gegenwärtig in aller Munde und die Einsatzbereiche im Gesundheitswesen sind sehr divers. Die auf dem Einsatz von KI-Softwares basierende automatische Frakturdiagnostik auf Röntgenbildern hat sich in den letzten Jahren beeindruckend entwickelt, jedoch vor allem in der Erwachsenenmedizin [1]. Im Bereich der Frakturdiagnostik bei Kindern und Jugendlichen ist diese Entwicklung vergleichsweise rückständig [2]. Zum heutigen Zeitpunkt gibt es vier CE-zertifizierte beziehungsweise für den amerikanischen Markt FDA-konforme KI-Softwares zur Frakturdiagnostik bei Kindern: BoneView (Gleamer, Paris, Frankreich), Rayvolve (Azmed, Paris, Frankreich), SmartUrgences (Milvue, Paris, Frankreich) und RBfracture (Radiobiotics, Kopenhagen, Dänemark). Zum Vergleich: für die Frakturdiagnostik bei Erwachsenen sind es mehr als drei Mal so viele [3]. Eine Erklärung für diesen Unterschied ist, dass das Erkennen von Frakturen des sich entwickelnden Skeletts auf Röntgenbildern komplexer ist. Entwicklungsbedingt ist das kindliche Skelett plastischer, wodurch bestimmte Frakturtypen nur im Kindesalter vorkommen (Biegungsfrakturen, Grünholzfrakturen, Torusfrakturen). Frakturen um die Wachstumsfugen (klassifiziert nach Salter und Harris) sind ebenso einzigartig im Kindes- und Jugendalter. Sehr spezifische Frakturtypen sind ausserdem die «toddler’s fractures» und Trampolinfrakturen, denen jeweils ein bestimmtes Alter beziehungsweise ein einzigartiger Frakturmechanismus zugrunde liegt und die zum Teil sehr schwierig zu erkennen sind. Okkulte / subtile Frakturen im Bereich des Ellbogens können zum Teil nur durch einen vorliegenden und im seitlichen Röntgenbild erkennbaren Gelenkerguss vermutet werden. Und zu guter Letzt gibt es im Bereich der Wachstumsfugen und Apophysen etliche Normalvarianten, die nicht mit Frakturen verwechselt werden dürfen, ebenso wie Ossifikationskerne, die zunehmend verknöchern und wachsen. Diese Besonderheiten der pädiatrischen Frakturdiagnostik machen zusammen mit einer deutlich kleineren Patientenpopulation die Entwicklung von KI-Softwares schwieriger und finanziell weniger lukrativ.
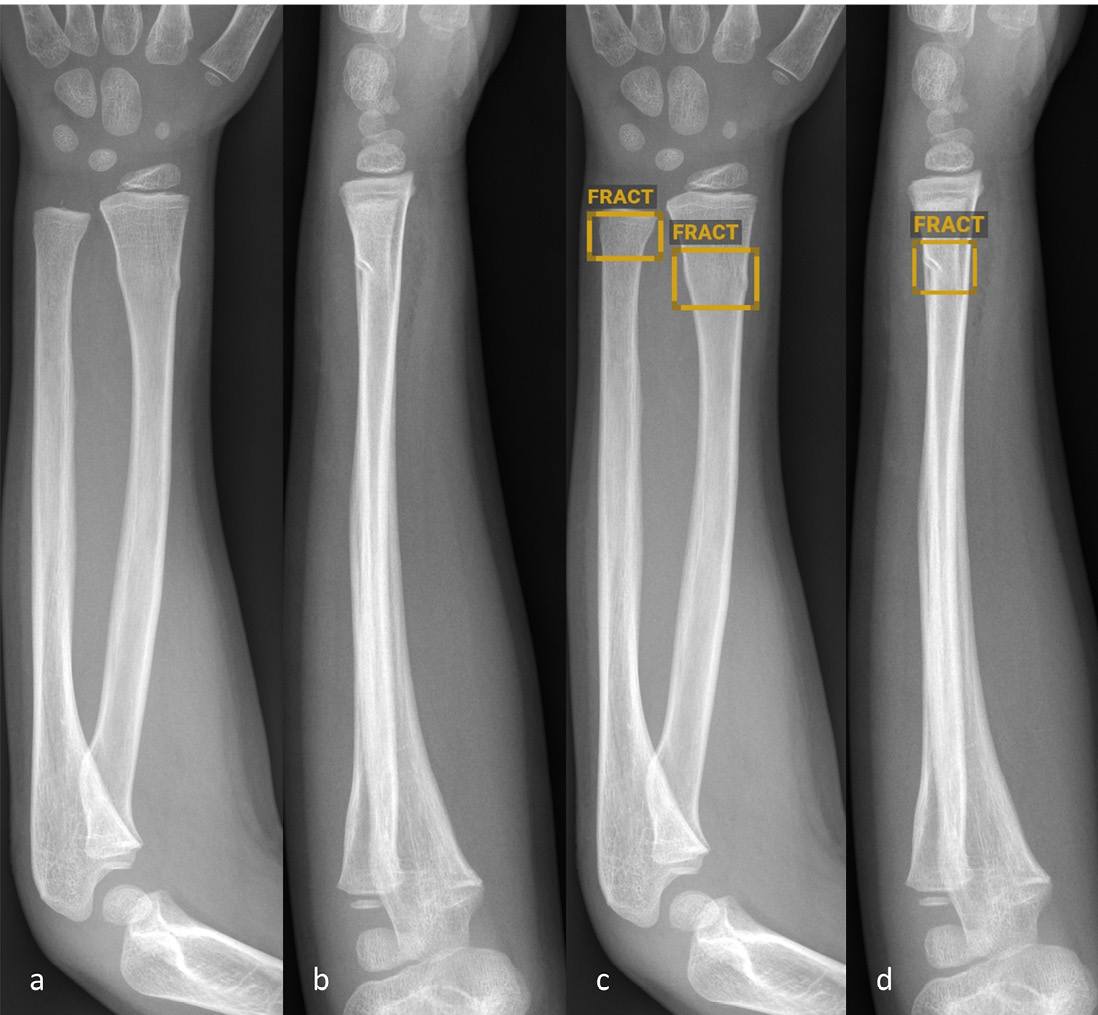
Abbildung 1: Anteroposteriore (a und c) sowie seitliche (b und d) Röntgenbilder des Vorderarms eines fünfjährigen Kindes ohne (a–b) und mit (cd) Befundmarkierung durch BoneView. Die KI-Software hat die distale metaphysäre Torusfraktur von Radius und Ulna korrekt identifiziert und markiert.
© Altmann-Schneider I, Kellenberger CJ, Pistorius SM, Saladin C, et al. Artificial intelligence-based detection of paediatric appendicular skeletal fractures: performance and limitations for common fracture types and locations. Pediatr Radiol. 2024; 54(1):136-145. http://creativecommons.org/licenses/by/4.0/ Die Abbildung entspricht einem Teil des Originals ohne sonstige Veränderung.
Chancen und Herausforderungen
Insgesamt gibt es vergleichsweise wenig publizierte Studien zur Frakturdiagnostik durch KI bei Kindern und Jugendlichen. Die wenigen durchgeführten externen Validierungsstudien der oben beschriebenen kommerziell erhältlichen Softwares zeigen durchweg relativ hohe Sensitivitäten und Spezifitäten (mehrheitlich über 90 %) der jeweils getesteten Softwares [4–6]. Die Studien variieren jedoch stark bezüglich Gesamtanzahl analysierter Röntgenbilder (zwischen 300 und 2634), Anzahl Röntgenbilder pro Altersgruppe sowie Auswertung der Ergebnisse. Nur eine der Studien schlüsselt die Ergebnisse nach spezifischen Frakturtypen auf, lässt dabei aber die anatomische Lokalisation ausser Acht [6]. In einer am Universitäts-Kinderspital Zürich durchgeführten Studie, haben wir kürzlich in einem Datenset von je 1000 Röntgenbildern häufiger Frakturlokalisationen bei Kindern (Vorderarme, Ellbogen und Unterschenkel) die diagnostische Genauigkeit der KI-Software BoneView (Gleamer) getestet [7]. Für die Gesamtheit aller Frakturen wurden ähnlich hohe Sensitivitäten und Spezifitäten wie in früheren Publikationen mit derselben Software gefunden [6]. Abbildung 1 zeigt ein Beispiel einer von der KI-Software korrekt identifizierten Torusfraktur des Vorderarms. Die Aufschlüsselung nach Frakturtyp hat jedoch deutliche Einschränkungen aufgezeigt. So wurden im Bereich der Vorderarme Biegungsfrakturen nicht verlässlich erkannt. Ausserdem war die Detektionsrate für Avulsionen des Processus styloideus ulnae, Torusfrakturen des proximalen Radius sowie Olekranonfrakturen im Vergleich zu den übrigen Vorderarmfrakturen deutlich geringer (< 80 %). Im Bereich der Unterschenkel wurden niedrige Detektionsraten für «toddler’s fractures» (74 %) und Trampolinfrakturen (66 %) gefunden. Bei den Ellbogen wurden nur komplette suprakondyläre Frakturen und Radiushalsfrakturen mit einer Detektionsrate über 80 % erkannt. Die Detektion von Gelenkergüssen im Ellbogen als indirektes Frakturzeichen war nur moderat. Luxationen im Ellbogengelenk wurden nicht verlässlich erkannt (Abbildung 2). Zusammenfassend lässt sich also festhalten, dass gerade die – zum Teil diskreten, jedoch äusserst relevanten – Befunde, die dem etwas weniger geübten Auge entgehen könnten, auch von der Software nicht verlässlich erkannt werden.
Abgesehen von der diagnostischen Genauigkeit der einzelnen Softwares hinsichtlich typischer Frakturen fehlt es zudem an Vergleichsstudien der kommerziell erhältlichen Frakturdetektionssoftwares, die den interessierten klinischen Fachkräften eine fundierte Basis zur Auswahl eines passenden Produktes bieten.
Ausblick
Da vor allem Nicht-Kinderradiologinnen und Nicht-Kinderradiologen von dem unterstützenden Einsatz von KI-Softwares durch Diagnosesicherung im Alltag profitieren könnten, erscheint eine Implementierung solcher Softwares angesichts der beschriebenen Einschränkungen aktuell noch nicht erfolgversprechend. Zukünftige prospektive Studien sind zudem notwendig, um den Einsatz von KI-Softwares im Alltag zu testen und die Auswirkungen auf die Diagnosestellung von Frakturen im Kindes- und Jugendalter zu evaluieren.
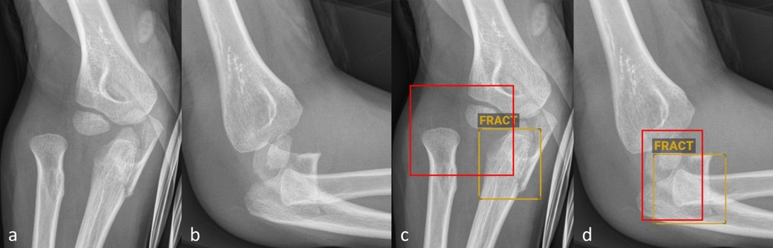
Abbildung 2: Anteroposteriore (a und c) sowie seitliche (b und d) Röntgenbilder des Ellbogens eines sechsjährigen Kindes ohne (a–b) und mit (c–d) Befundmarkierung durch BoneView. Die KI-Software hat die proximale Ulnafraktur korrekt identifiziert und markiert, die Radiusluxation im Rahmen der Monteggia-Luxationsfraktur jedoch nicht erkannt (roter Rahmen, c–d).
© Altmann-Schneider I, Kellenberger CJ, Pistorius SM, Saladin C, et al. Artificial intelligence-based detection of paediatric appendicular skeletal fractures: performance and limitations for common fracture types and locations. Pediatr Radiol. 2024; 54(1):136–145. http://creativecommons.org/licenses/by/4.0/ Die Abbildung entspricht einem Teil des Originals ohne sonstige Veränderung.
Literatur
- Offiah AC. Current and emerging artificial intelligence applications for pediatric musculoskeletal radiology. Pediatr Radiol. 2022; 52(11):2149–2158.
- Shelmerdine SC, White RD, Liu H, Arthurs OJ, et al. Artificial intelligence for radiological paediatric fracture assessment: a systematic review. Insights Imaging. 2022; 13(1):94.
- Pauling C, Kanber B, Arthurs OJ, Shelmerdine SC. Commercially available artificial intelligence tools for fracture detection: the evidence. BJR Open. 2024; 6(1):tzad005.
- Dupuis M, Delbos L, Rouquette A, Adamsbaum C, et al. External validation of an artificial intelligence solution for the detection of elbow fractures and joint effusions in children. Diagn Interv Imaging. 2024; 105(3):104-109.
- Dupuis M, Delbos L, Veil R, Adamsbaum C. External validation of a commercially available deep learning algorithm for fracture detection in children. Diagn Interv Imaging. 2022; 103(3):151–159.
- Hayashi D, Kompel AJ, Ventre J, Ducarouge A, et al. Automated detection of acute appendicular skeletal fractures in pediatric patients using deep learning. Skeletal Radiol. 2022; 51(11):2129–2139.
- Altmann-Schneider I, Kellenberger CJ, Pistorius SM, Saladin C, et al. Artificial intelligence-based detection of paediatric appendicular skeletal fractures: performance and limitations for common fracture types and locations. Pediatr Radiol. 2024; 54(1):136-145.
